近日,海南大学李海燕团队在Plant Biotechnology Journal杂志在线发表了”GmAKT1-mediated K+ absorption positively modulates soybean salt tolerance by GmCBL9-GmCIPK6 complex”的研究论文。该研究工作通过创制过表达和敲除大豆材料,鉴定到钾离子通道蛋白基因GmAKT1具有正向调控大豆耐盐性的作用。然后,对GmAKT1的上游调控网络进行解析,通过互作蛋白筛选,明确了大豆中存在GmAKT1与GmCIPK6以及GmCIPK6与GmCBL9的相互作用关系,以此构成一个“GmCBL9-GmCIPK6-GmAKT1”调控大豆耐盐性的分子模块。进一步,结合电生理体系以及多基因聚合大豆材料表型分析等,揭示GmCBL9-GmCIPK6复合体通过磷酸化并激活GmAKT1对K+的吸收,进而维持体内Na+/K+平衡,最终提高大豆耐盐性的分子机制。

大豆[Glycine max (L.) Merr.]是世界第一大豆科作物,也是重要的粮、油、饲兼用作物,与国民经济息息相关。然而,我国大豆单产一直增加缓慢,加之人们对优质蛋白和食用油的需求日渐增多,国内较低的大豆产量已无法满足人们需求,每年约85%大豆来源于进口,这一现状已成为我国大豆在国际竞争中“卡脖子”的关键因素。此外,大豆作为一种中度盐敏感作物,在土壤盐度电导率(ECe)超过5 ds/m的条件下,其植株的致死率和叶片坏死现象会显著加剧,进而导致大豆产量下降50%,对我国粮食安全造成极大影响(Phang et al., 2008; Zhao et al., 2020)。因此,充分利用盐碱土地,培育耐盐大豆新品种(系)已迫在眉睫。值得注意的是,盐胁迫下大量的Na+进入植物细胞中会抑制K+吸收,进而导致Na+/K+比失衡,最终造成植物细胞损伤和营养缺乏(Anschütz et al., 2014;Ismail et al., 2017;Li et al., 2023)。因此,维持细胞内钠离子/钾离子(Na+/K+)平衡是植物耐盐的关键因素之一(Yang et al., 2018)。此外,盐胁迫下一些离子通道或转运体蛋白可通过调节K+吸收或Na+外排进而维持Na+/K+平衡(Zhu et al., 2016)。然而,目前研究主要集中于Na+转运调控机制方面,有关盐胁迫下K+转运的分子机制研究仍相对有限(Wang et al., 2020; Jia et al., 2021; Chen et al., 2023)。海南大学李海燕课题组在大豆中鉴定到一个K+通道蛋白基因GmAKT1,且该蛋白受到上游GmCBL9-GmCIPK6复合体的调控,阐明了K+调控大豆耐盐性的分子机制。全文主要研究结果如下:
1. K+通道蛋白基因GmAKT1正向调控大豆耐盐性
研究人员首先对GmAKT1的过表达和敲除大豆进行盐胁迫处理,发现盐胁迫下过表达GmAKT1株系的Fv/Fm以及根和叶片中的干鲜重显著高于野生型,而在敲除GmAKT1株系则显著低于野生型 (图1b-f)。进一步研究表明,盐胁迫下过表达GmAKT1根和叶片中的Na+含量以及Na+/K+比值显著低于野生型,K+含量显著高于野生型,而敲除GmAKT1株系则与之相反。通过以上研究表明GmAKT1基因可通过调节K+吸收,进而维持Na+/K+平衡,最终增强大豆耐盐性(图 1g-k)。
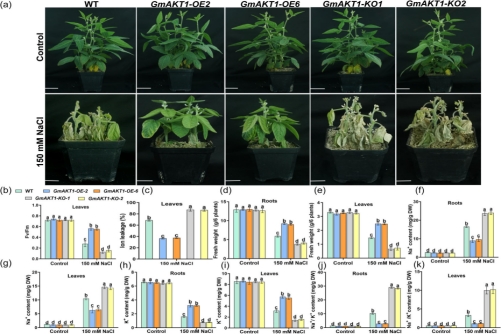
图1 GmAKT1在大豆中的耐盐性鉴定
2. 蛋白激酶GmCIPK6相互作用并磷酸化修饰GmAKT1
为了进一步探究GmAKT1是否受到上游蛋白激酶GmCIPKs的调控,进而提高大豆耐盐性,研究人员首先鉴定并克隆了26个大豆GmCIPKs基因,并利用Y2H实验验证了GmAKT1与GmCIPK4、GmCIPK6、GmCIPK14和GmCIPK23具有相互作用关系(图 2a)。然后,通过BiFC和Co-IP实验证实了在植物体内GmAKT1与GmCIPK6也存在相互作用关系(图 2b-c)。在此基础上,明确了GmAKT1中的Ankyrin是与GmCIPK6相互作用的关键功能结构域(图 2d)。最后,通过Mn2+-phos-tag SDS PAGE以及Western blot检测,验证了GmCIPK6可以磷酸化GmAKT1及其磷酸化位点(图 2e-g)。这些研究结果证实,GmAKT1介导K+吸收受到GmCIPK6的磷酸化激活作用。
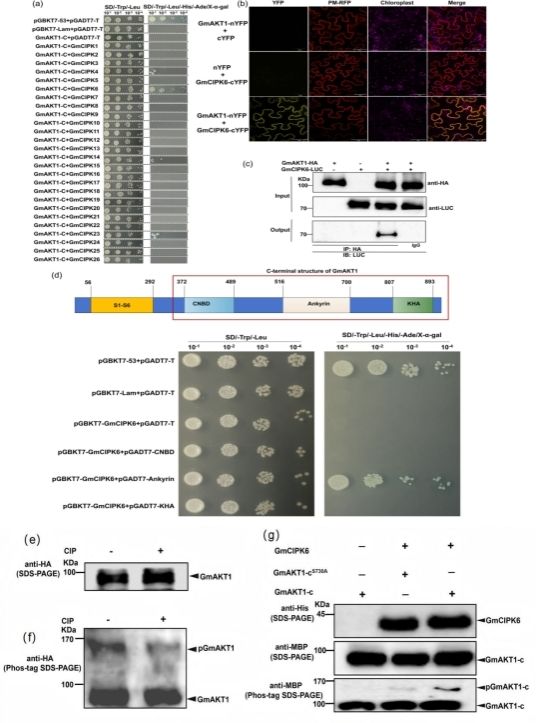
图2 GmCIPK6相互作用并磷酸化修饰GmAKT1的验证
3. GmCIPK6活性受到上游钙离子感受器GmCBL9的调控
为了明确GmCIPK6是否受到上游钙离子(Ca2+)感受器GmCBLs的调控,研究人员首先通过Y2H实验证明了GmCIPK6与大豆中的GmCBL1、GmCBL2以及GmCBL9相互作用(图 3a)。进一步通过BiFC和Co-IP实验证了在植物体内GmCIPK6与GmCBL9存在相互作用关系(图 3b-c)。值得注意的是,研究者通过亚细胞定位分析发现,GmCBL9和GmAKT1定位在细胞膜上,GmCIPK6定位在细胞核上(图 3d)。而BiFC结果显示,GmCBL9与GmCIPK6以及GmCIPK6与GmAKT1相互作用后都定位在细胞膜上(图 2b,3b),通过以上结果,研究者推断GmCBL9与GmCIPK6相互作用后,GmCBL9可能将GmCIPK6从细胞核招募至细胞膜上,进而使GmCIPK6与定位在细胞膜上的GmAKT1发生相互作用。
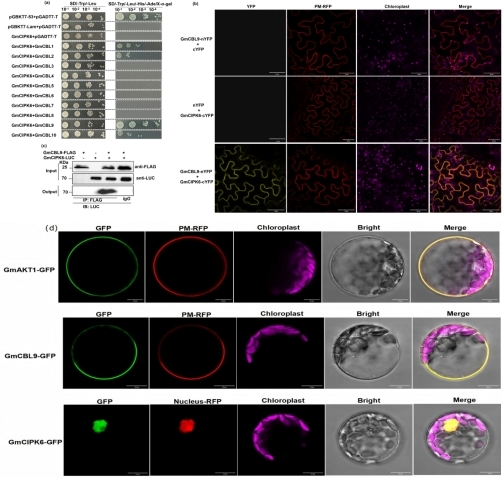
图3 GmCIPK6相互作用GmCBL9的鉴定
4. GmCBL9-GmCIPK6复合体通过磷酸化激活GmAKT1以提高大豆的耐盐性
为了进一步明确GmAKT1介导K+吸收是否受到Ca2+-GmCBL9-GmCIPK6复合体的调控,研究者利用全细胞膜片钳检测不同转染细胞中K+向细胞内整流的情况。首先,将钙离子感受器GmCBL9中与Ca2+结合的位点进行突变,发现转GmCBL9E172Q、GmCIPK6和GmAKT1的HEK293T细胞中,K+向细胞内整流趋势显著降低(图 4d-e),表明GmAKT1介导K+吸收依赖于Ca2+信号网络的调控。进一步研究发现,与单转GmAKT1的细胞相比较,共转GmCBL9、GmCIPK6和GmAKT1细胞中K+向细胞内整流趋势显著增加,表明Ca2+-GmCBL9-GmCIPK6复合体促进GmAKT1对K+吸收(图4a-b)。此外,为了验证GmAKT1介导K+吸收是否依赖于上游GmCBL9-GmCIPK6的磷酸化调控,研究者将GmAKT1的磷酸化位点进行突变,然后对转GmCBL9、GmCIPK6和GmAKT1S730A的细胞进行电流检测,发现GmAKT1的磷酸化位点突变后,K+向细胞内整流趋势显著降低(图4c)。通过以上研究结果,表明了GmAKT1介导K+吸收依赖于Ca2+-GmCBL9-GmCIPK6复合体的磷酸化修饰作用。另外,研究者以过表达/敲除GmAKT1以及野生型大豆为背景材料,利用大豆发状根体系分别过表达GmCBL9、GmCIPK6以及GmCBL9+GmCIPK6基因至上述大豆材料中,并通过分析盐胁迫下不同转基因大豆发状根的表型、Na+、K+含量以及Na+/K+比值的变化关系(图 4f-i),揭示了GmCBL9-GmCIPK6复合体通过磷酸化并激活GmAKT1对K+吸收,以维持体内Na+/K+平衡,最终提高大豆耐盐性。
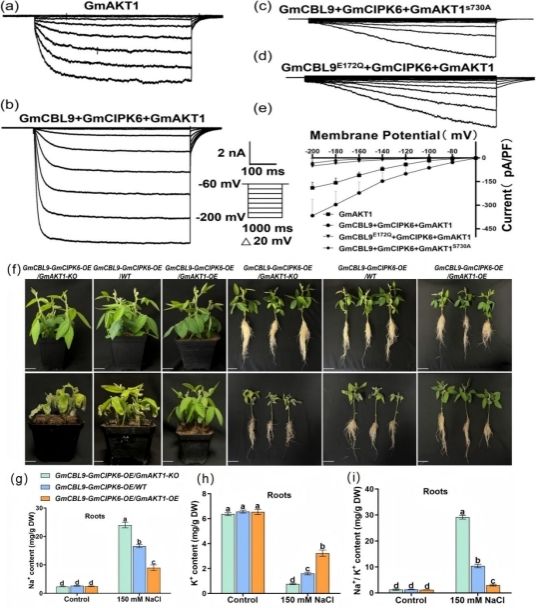
图4 GmCBL9-GmCIPK6复合体通过调控GmAKT1提高大豆的耐盐性
这项研究证实了钾离子通道蛋白基因GmAKT1参与调控大豆耐盐性的分子机制,即盐胁迫下Ca2+感受器GmCBL9接收到Ca2+后,将蛋白激酶GmCIPK6从细胞核招募至细胞膜上,进一步GmCIPK6通过磷酸化作用激活了定位在细胞膜上的K+通道蛋白GmAKT1。通过GmCBL9-GmCIPK6-GmAKT1这一分子模块的调控,促进了K+吸收,进而维持细胞内Na+/K+平衡,最终提高大豆的耐盐性(图 5)。
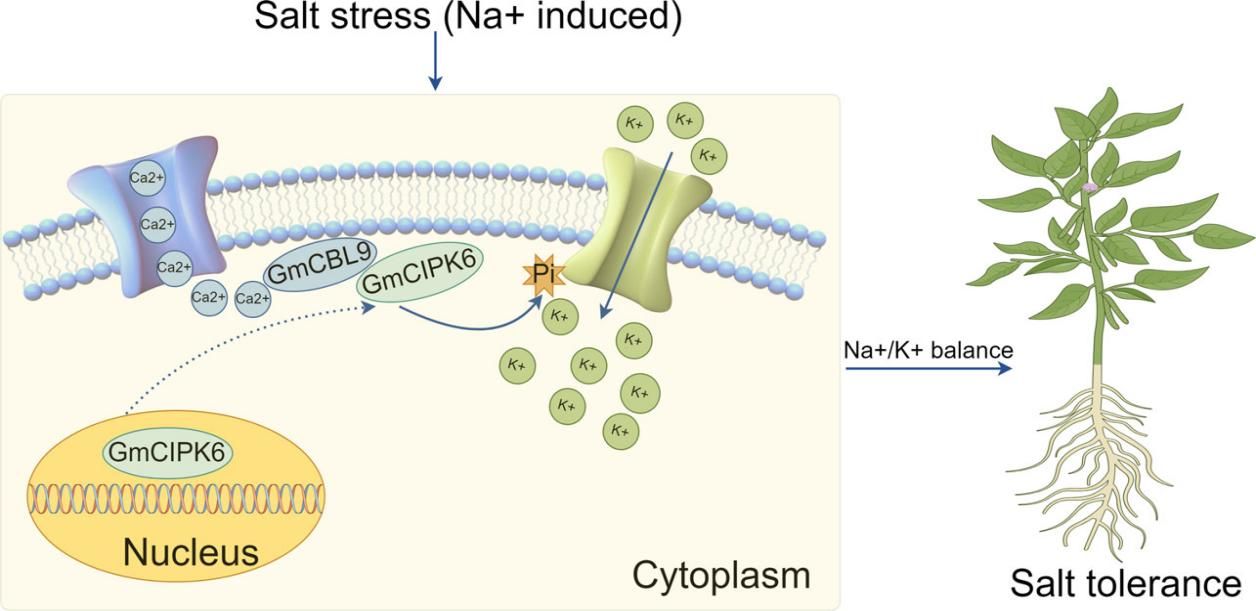
图5 GmCBL9-GmCIPK6-GmAKT1调控大豆耐盐性的作用模型
海南大学南繁学院(三亚南繁研究院)博士后冯晨和Muhammad Azhar Hussain(已出站)为该论文共同第一作者,海南大学南繁学院(三亚南繁研究院)李海燕教授和周永刚副教授为论文的共同通讯作者。研究工作得到了农业部科技创新2030-农业生物育种重大项目、国家自然科学基金和中国博士后科学基金的资助。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1111/pbi.70042.
 海南大学
海南大学
 南繁研究院
南繁研究院